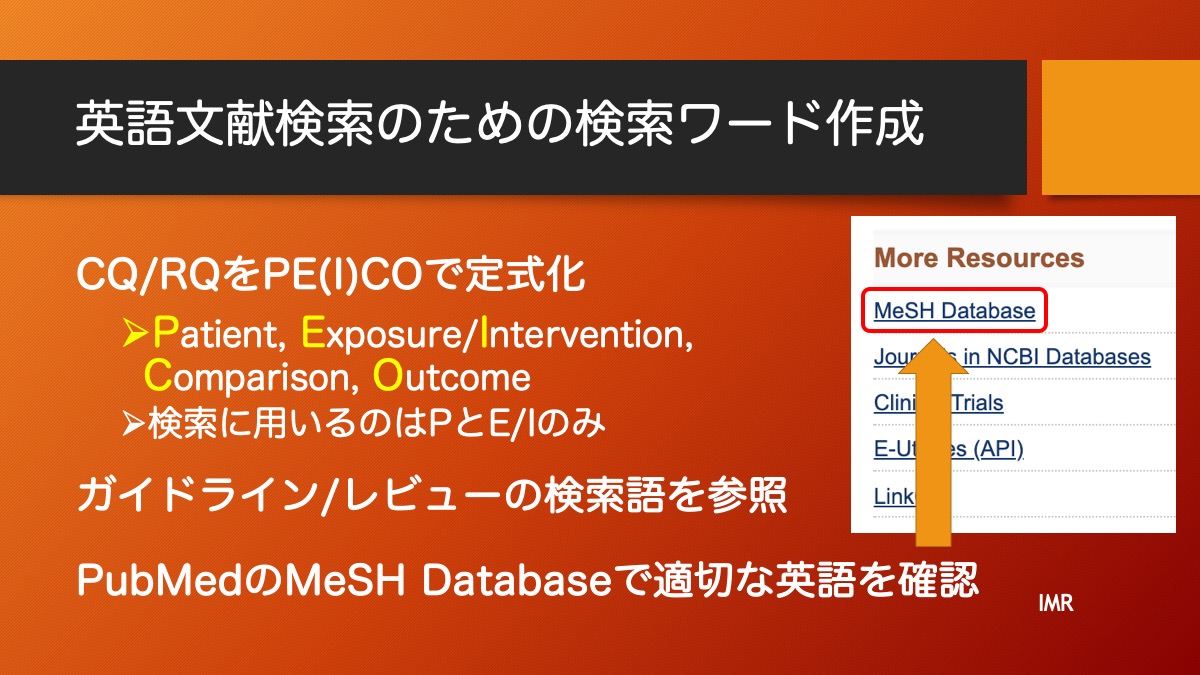
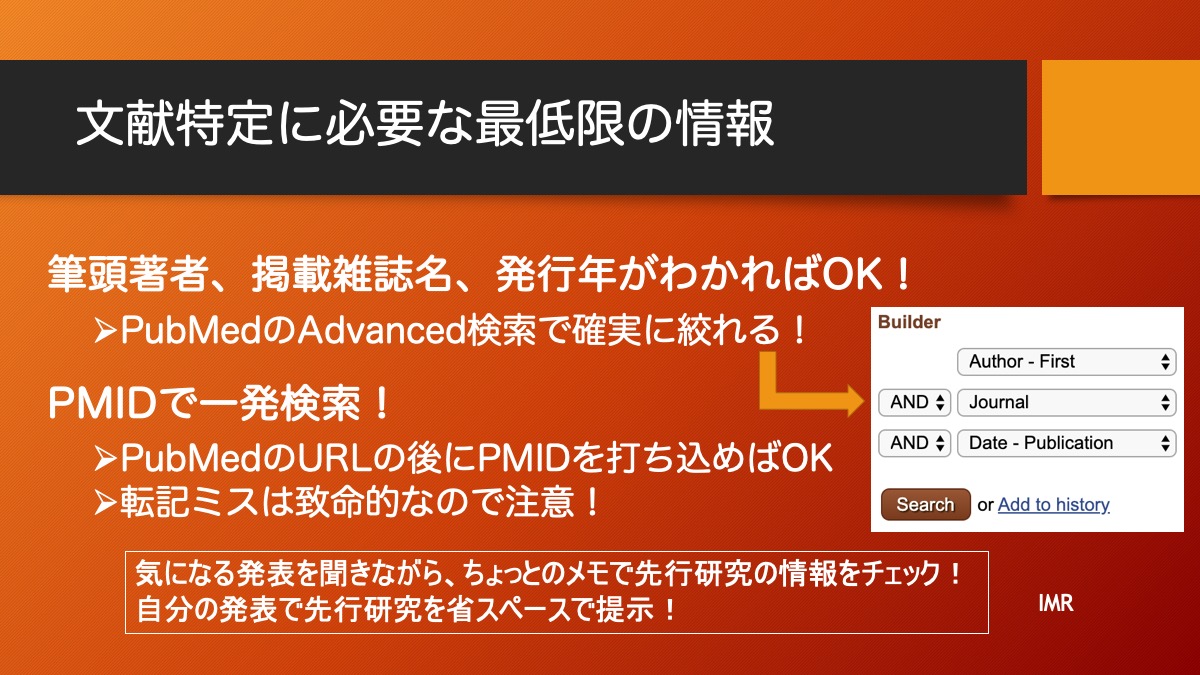
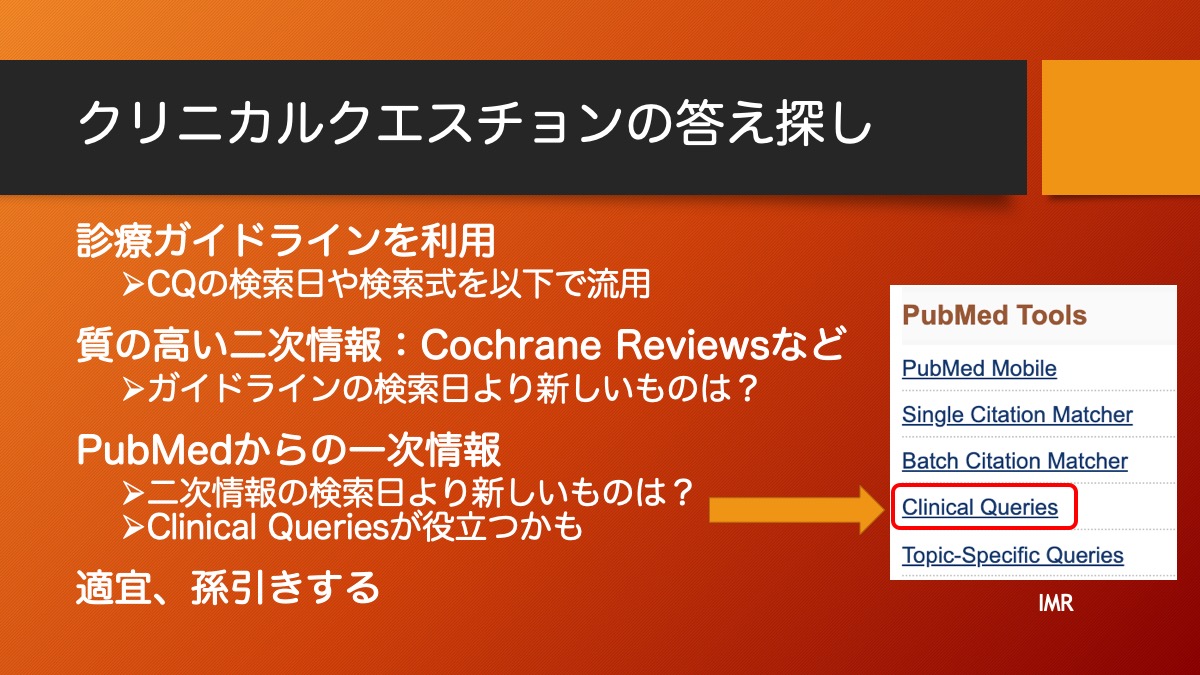
研究計画にあたり、仮説をどのように検証するか、研究デザインを考える必要があります。
研究デザインといえば、最もエビデンスが高いのはランダム化比較試験(RCT)なので、とにかくRCTをすればいい、RCTをしてないのはただの怠慢!かというとそういうわけではありません。それぞれの研究デザインを用いる理由があるわけです。
今回は、エビデンスレベルを「土台から固めていく」という観点から、RCT以外の研究デザインの研究計画を立てる意義を考えます。
RCTが適さない場面
当然、RCTができれば、その仮説を高いエビデンスレベルで証明することができます。
しかし、RCTにもデメリットがあることを認識する必要があります。
RCTのデメリット
・介入により本来受けずに済んだはずの有害事象を被験者に与える可能性
・介入により本来受けるはずだった治療による利益を被験者が受けられない可能性
・RCT実施に伴うコスト
ちなみに、RCTを計画するにあたり事前に症例数を計算するのは、このようなデメリットを最小限にすることも目的の1つでした。
メリット、デメリットが十分わかっていない時
治験で実際に効果検証のRCTである第3相試験を実施するに当たって、事前に、
第1相試験:ボランティアを対象に安全性や薬物動態を確認
第2相試験:安全性が確認された範囲内で比較的少人数を対象に有効性、用法用量を確認
を実施します。
これはつまり、①有害事象などのデメリットが比較的少ないこと、②どの程度のメリットが見込めるか、の両者を確認した上で、本格的なRCTを実施しているということです。
第3相の大規模RCTでの事前の症例数計算をするには、どの程度の効果量が見込めるかを設定する必要がありますが、そのような意味でも比較的少人数を対象にしたRCTである第2相試験の存在は重要になります。
そもそもRCTが不可能な時
RCTが不可能なケースというのは、例えば、
1 極めて稀な疾患でRCTできるほどの症例集積が見込めない
2 介入の選別は倫理的に問題がある
3 研究目的がRCTに向かない
という場面です。
2の介入の選別は倫理的に問題がある、というケースですが、例えば「喫煙は肺癌のリスクかどうか」を調べるためには、研究参加者を有無を言わさず「喫煙を続ける群」と「喫煙をしない群」にランダムに振り分ける必要がありますが、この割付は倫理的に問題があるのは明らかでしょう。
研究目的がRCTに向かない、というのは、例えば「診断のための検査」の精度を評価する場合は、ある診断を満たす群とそうでない群の全例にその検査を施行し、感度特異度を評価する事になりますが、RCTは向きません。
研究目的に応じて研究デザインを考える必要があります。
エビデンスヒエラルキーは土台から固めていくもの
RCTをするのが適さない「メリット・デメリットがよくわかっていない」を解消するにはどうすればいいのでしょうか。わかりやすいのはエビデンスヒエラルキーを考える事です。

治療のエビデンスレベル
あるリサーチクエスチョンに対して、これまでどのような研究がなされているかを検討した時、例えばすでにコホート研究が報告され、ある程度のエビデンスが蓄積しているのであれば、そこから効果量などを推定し、症例数計算を実施し、RCTを行うのは理にかなっています。
しかし、まだケースシリーズも報告されていないようなリサーチクエスチョンに対していきなりRCTをするのは、コストが明らかなのに対し、実際にどの程度の見込みがあるか全くわからず、無謀なものと言えます。
エビデンスヒエラルキーは「とにかくトップを目指す」ではなく、あるリサーチクエスチョンに対し、土台から固めて行き、最終的にRCT/メタアナリシスを行う、という見方をするのは大事なことです。
すでにある程度ケース・コントロール研究を行い、なんらかの仮説が立ってきたのであれば、次はコホート研究を行っていく、というように土台から積み重ねていくわけです。
このように、エビデンスを土台から積み重ねていくためには、臨床研究を行うにあたって、今解決しようとしているリサーチクエスチョンに、これまでどの程度の研究がなされているか(どんな研究デザインで解明されているのか)を調べる必要があります。
もし調べたいと思っていたテーマに対して、論文があったとしても、エビデンスレベルの低い研究しかないのであれば、それよりもレベルの高い研究デザインの研究計画を立て、その仮説に対するより質の高い回答を提示する、と考えるのも一つの考え方になります。